カゴメアイス
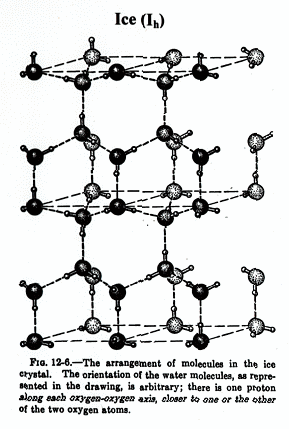
左下図に六方晶氷の結晶構造を示します。そこでは酸素イオンがダイヤモンド類似の格子を組み、2つの隣接する酸素イオン間に一つの水素イオンが存在します。よって1つの酸素イオンは4つの水素イオンによって囲まれており、水素イオンの4面体の中心に位置するとみなすことが出来ます。しかし、ここで氷がH2O分子の集まりであることを考えると、4つの水素イオンのうち2つが近づいて化学結合を作り、残りの2つが遠ざかって隣の酸素イオンに属することになります。
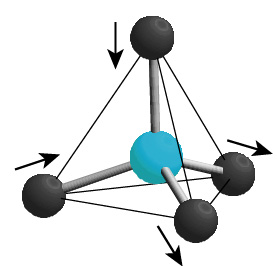
60年以上前にLinus Paulingは面白いことに気が付きました。氷が出来る過程において、各水素4面体につき、どの2つの水素イオンが選ばれるかに自由度があり、これは4C2=6通りあります(中下図)。さらに1つの4面体で水素イオンの位置を決めても、お隣の4面体にはまだ自由度が残り、これを無数の4面体が3次元的に繋がった氷で考えると、巨視的な自由度が残されることになります。水素イオンの位置には2つのポテンシャルミニマムがあるわけですから、その位置に関する全エントロピーは、水素イオン1モル当たりRln2(5.76 J/K mol)で与えられ、熱力学第3法則(絶対零度ではエントロピーがゼロ)に従うと、このすべてのエントロピーが絶対零度で解放されなければなりません。しかしながらPaulingの見積によると、水素イオン1モルあたり(R/2)ln(3/2)(1.69 J/K mol)のエントロピーが残されることになります。これを残留エントロピーとかゼロ点エントロピーと呼びます。一見、熱力学第3法則が破られたかに見えますが、そんなはずはなく、どこかにトリックが隠されています?
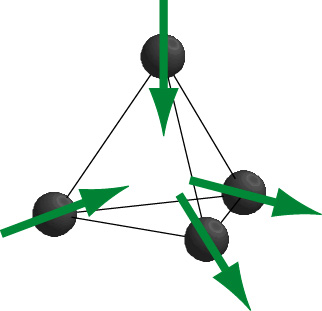
この不思議な氷の残留エントロピーの問題は実験的に取り扱うことは難しく、長年の間、置き去られてきましたが、そこで登場するのがパイロクロア酸化物です。もし、水素イオンの位置にイジングスピンがあり、四面体の中心かその反対のみを向く二つの状態しか取れないとすると(右下図参照)、その向きが水素イオンの位置に関する自由度と等価になります。さらに、四つのスピンのうち二つが内向き、二つが外向きのスピン配置が安定であるならば、これはまさに氷の問題と一致することがわかります。 Dyスピンは確かにこのようなイジングスピンであり、また、強磁性的な相互作用は右下図のようなtwo-in,two-out構造を安定化します。
このようにスピン系はしばしば、その他の系のモデル物質を与えます。スピン系における実験を通してその本質に迫ることが可能となります。さらにスピン系では外部磁場を制御することにより系のエネルギー状態を自由に変化させて実験を行うことが可能となります。
では、Dy2Ti2O7に戻りましょう。


